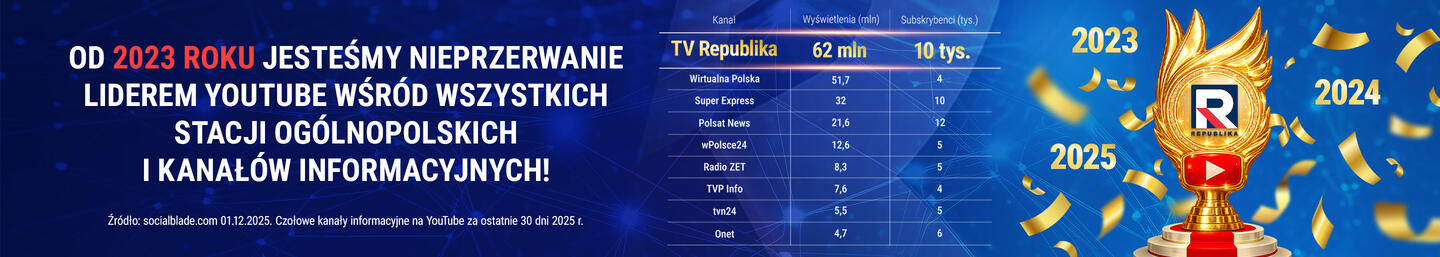
Lek oparty na przeciwciałach Covid-19. Firma GSK złożyła wniosek o dopuszczenie do użytku
Firmy GSK i Vir Biotechnology ogłosiły w piątek, że złożyły wniosek do amerykańskiej Agencji Żywności i Leków (FDA) o dopuszczenie do użytku w trybie nadzwyczajnym leku opartego na przeciwciałach monoklonalnych do stosowania w początkowych stadiach Covid-19.
Lek o nazwie VIR-7831 jest przeznaczony dla osób powyżej 12 lat odczuwających łagodne lub umiarkowane objawy Covid-19, których stan grozi pogorszeniem.
Opublikowane w marcu wstępne wyniki badań klinicznych nad środkiem wykazały, że podanie leku wiązało się z 85-proc. zmniejszeniem ryzyka hospitalizacji i śmierci w porównaniu z grupą, która nie otrzymała tej terapii.
Badania laboratoryjne sugerują ponadto, że środek działa przeciwko wszystkim groźnym wariantom koronawirusa.
Firmy z siedzibami w Londynie i San Francisco zapowiedziały "kontynuację dyskusji" z Europejską Agencją Leków (EMA) oraz innymi urzędami regulacyjnymi, by uzyskać zezwolenie na użytek leku na całym świecie.
Polecamy Cejrowski w Republice
Wiadomości
Najnowsze

Wiosna coraz bliżej. Ekspert IMGW o tym, co czeka Polskę w najbliższych dniach

Koniec „El Mencho”. Meksyk likwiduje najpotężniejszego bossa narkotykowego

Cejrowski dosadnie o niemieckich zamiarach: chcą, żeby Polska spłacała ich zbrojenia!